京都医塾化学科の榊原です。化学を教えて長いのですが、生徒のタイプも様々。化学は嫌いでは無く、むしろ好きなのに、いつまで経っても計算問題が苦手で、そのせいでテストの成績が上がらない、といった方が毎年一定数以上います。四則演算の速さ、正確さがあるに越したことはありませんが、計算に取り掛かる前にちょっとした工夫をする習慣を身に付けてもらえれば、苦労して計算したのに答えが合わないという事態は回避できる筈。そんな工夫のいくつかを紹介したいと思います。計算問題を克服する一助になれば幸いです。今回は...
問題1.
0℃、1.013×105Paで1.68Lのプロパンに、0℃、1.013×105Paで8.96Lの酸素を混合し、この混合気体に点火すると、一方の気体の一部が未反応のまま残り、二酸化炭素と水が生成した。ただし、原子量はH=1.0,C=12,O=16 とする。
問1.未反応で残った気体は何か。また、何g残ったか。
問2.生成した二酸化炭素の体積は、0℃、1.013×105Paで何Lか。
問3.生成した水の質量は何gか。

もう、2題ほど例題を...
問題2.
次の各気体について、含まれる原子の総数の大小関係を等号(=)、不等号(⋗)を用い、例にならって答えよ。ただし、原子量はH=1.0,C=12,O=16 とする。 例;A>B=C>D
A;アルゴン20.0g B;アンモニア4.25g C;0℃、1.013×105Paで11.2Lを占める水素 D;窒素4.2gと酸素3.2gの混合気体

問題3.
密度1.26g/cm3の希硫酸1.00mLを1.00mol/Lの水酸化ナトリウム溶液で滴定したところ、9.00mLを 要した。希硫酸の質量パーセント濃度(%)を求めよ。
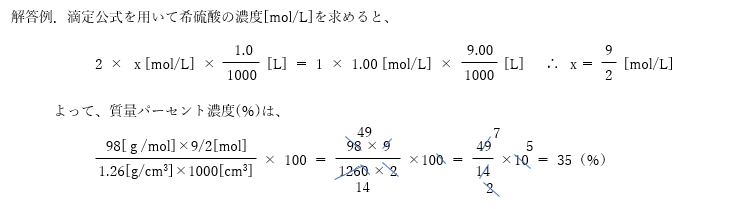
まとめ
最後の例題は、計算に分数の約分を用いているだけじゃないかと言われれば確かにそうなので、次回は「計算式を立て切ってから計算に臨め」とでもしますかね。全ての計算が約分計算で済むわけでは無いので、意味が無いと感じる人も居るかもしれませんが、出来るだけ式を簡単にしてから計算に取りかかるのが鉄則ですから、はやる心を制しながら、きちんと立式する事を習慣づけて下さい。「約分出来て計算が楽になったらラッキー!」ぐらいのつもりで臨めば、精神的なダメージは減りますし、約分計算が連鎖して次々と消えていく問題に出会うと、「テトリス」や「ぷよぷよ」には到底及びませんが、そこそこ快感ですよ。前回も書きましたが、何事も経験です。勇気を出して踏み出さないと何事も変わりません。是非試して欲しいですし、習慣付けができたらしめたものです。計算問題の正答率は飛躍的に、は大袈裟ですが、必ず上昇すると思います。否、上昇させるべく鍛錬を怠らない事!ですかね。


